Titrasi Asama Basa
Defenisi titrasi
Suatu metode kuantitatif yang digunakan untuk mengetahui konsentrasi suatu zat dengan menambahkan zat yang sudah diketahui konsentrasinya. Zat yang ingin diketahui konsentrasinya disebut titrat dan zat lain yang ditambahkan untuk bereaksi dengan titrat disebut penitrasi atau titran. Titrasi asam basa menggunakan konsep reaksi penetralan asam basa.
Larutan standar
Zat yang digunakan sebagai penitrasi atau titran adalah larutan standar yang sudah diketahui konsentrasinya.
Komponen titrasi asam basa
Indikator titrasi asam basa
Indikator zat penunjuk kapan titrasi harus dihentikan atau sudah selesai, indikator memiliki warna berbeda dalam kondisi asam dan basa.
Titik Ekuivalen dan titik akhir titrasi asam basa
Titik ekuivalen adalah titik dimana asam dan basa tepat habis bereaksi (secara teoritis), sedangkan titik akhir titrasi adalah titik dimana titrasi harus dihentikan ditandai perubahan warna larutan karena penambahan indikator.
Proses titrasi
1. Titrasi dilakukan secara perlahan, titran tetes demi tetes dicampur ke dalam sampel (titrat)
2. Tabung erlenmeyer selalu dikocok atau digoyang agar reaksi terjadi secara sempurna
3. Proses dilakukan hingga mencapai titik ekuivalen
4. Titrasi dihentikan ketika sudah sampai pada titik akhir titrasi jika warna telah berubah
Analisis Konsentrasi dengan Titrasi
Tujuan utama dari titrasi adalah menentukan konsentrasi dari sampel (titrat), dengan menggunakan persamaan:
Va x Ma x a = Vb x Mb x b
keterangan
Va = volume asam (ml)
Ma = konsentrasi asam (molaritas)
a = valensi asam (koefisien disosiasi dari (H+)
Vb = Volume basa (ml)
Mb = konsentrasi basa (molaritas)
b = valensi basa (koefisien disosiasi dari (OH-)
Catatan : percobaan harus dilakukan berulang (mengurangi tingkat kesalahan/hasil agar maksimal) sehingga volume titran adalah volume rata-rata dari semua percobaan
Jenis titrasi asam basa
Kurva titrasi merupakan hubungan antara pH dengan volume penitrasi.
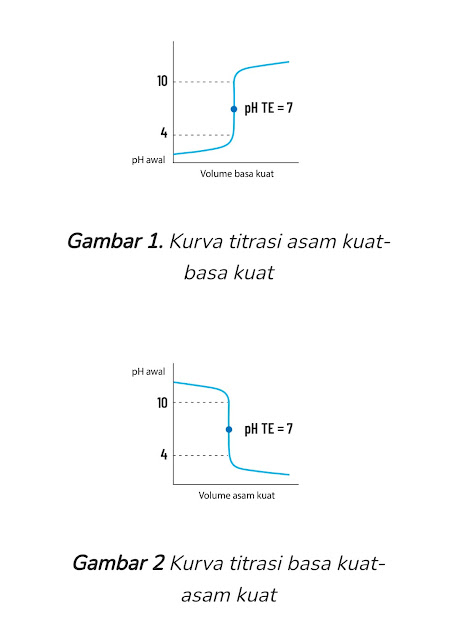
1. Kurva titrasi asam kuat-basa kuat
Titrannya adalah basa kuat. Titik ekuivalen terjadi pada pH = 7 (gambar 1), menggunakan indikator fenolftalein karena memberikan perubahan warna dari tidak berwarna menjadi merah muda.
2. Kurva titrasi basa kuat dengan asam kuat
Titrannya adalah asam kuat. Titik ekuivalen terjadi pada pH = 7 (gambar 2), dinjurkan menggunakan indikator fenolftalein karena memberikan perubahan warna tajam dari warna merah muda menjadi tidak berwarna.
3. Kurva titrasi basa lemah dengan asam kuat
Pada titrasi ini, titran yang digunakan asam kuat. Titik ekuivalen terjadi pada pH antara pH 5 sampai pH 6 (gambar 3). Indikator yang digunakan metil merah dan bromtimol biru.
4. Kurva titrsi asam lemah dengan basa kuat
Pada titrasi ini, titran adalah basa kuat. Tititk ekuivalen terjadi pada pH 8 sampai pH 9 (gambar 4). Indikator yang bisa digunakan berupa bromtomol biru dan fenolftalein.
Baca Juga : Membahas Soal Titrasi Asam Basa